 |
Lectures requises : Convergence 9, pages 138, 141 et 144. |
Comment les atomes forment-ils des molécules et comment
restent-ils ensemble?
Pour répondre à ces questions, il faut faire un retour
sur la nature de l'atome et les caractéristiques des composés
ioniques et moléculaires. Tu sais que selon le modèle
de nuage électronique, les électrons circulent autour
du noyau de l'atome. Puisque le nombre d'électrons varie
d'élément en élément, il est facile de conclure que les atomes des éléments possèdent
des grosseurs différentes.
Pour bien expliquer comment les molécules se forment, il
faut se tourner vers les caractéristiques des composés.
Pour former des molécules de composés ioniques,
les atomes cèdent (perdent) ou acquièrent
(gagnent) des électrons. Il en résulte une différence
de charge et un peu comme le sud d'un aimant attire le nord, les
charges positives et négatives s'attirent. Les ions positifs
sont attirés par les ions négatifs et la stabilité des
molécules ioniques formées est due à
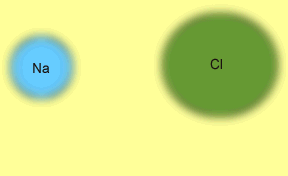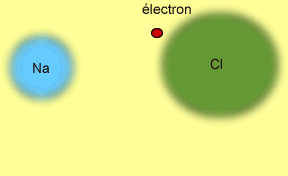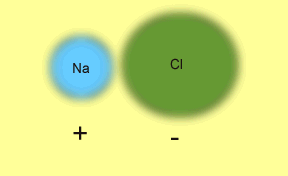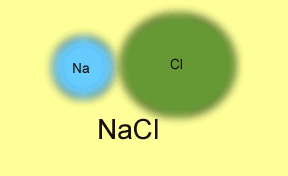
cette force d'attraction. L'image animée suivante illustre
le processus de transfert d'un électron entre le Na et
le Cl pour former une molécule stable de NaCl. En perdant
son électron le sodium devient le cation Na+ et
le chlore, en acceptant l'électron perdu par le sodium
devient l'anion Cl-. Les deux ions de charges contraires
s'attirent.
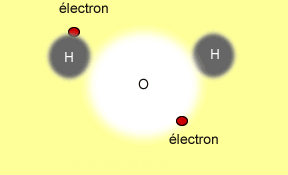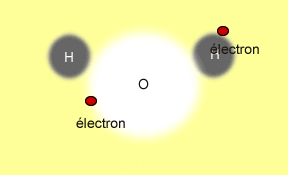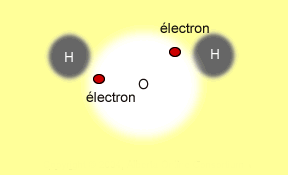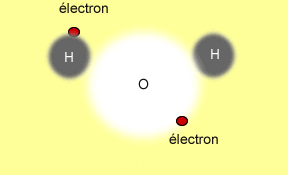
Pour ce qui est des composés moléculaires,
le processus est différent. Les électrons ne sont
pas transférés mais ils sont plutôt partagés
entre les atomes. Il en résulte ce qu'on appelle une liaison
covalente. Mais c'est néanmoins les électrons qui
maintiennent la molécule ensemble. Tu auras la chance
d'étudier les liaisons chimiques au cours des années à
venir. L'image animée suivante illustre grossièrement
le processus de partage d'un électron entre deux atomes
d'hydrogène pour former une molécule d'hydrogène
H2.
|

