- Mes cours
- CFÉD
-
CPFPP
Vue d'ensemble Nouveau curriculum (2022) Série sur l'évaluation pour faire rayonner nos élèves Les outils d'aide à l'apprentissage Communautés collaboratives au secondaire Éducation à la réconciliation - À la croisée des apprentissages (octobre 2024) Symposium des Rocheuses (Archives) Microformations sur la profession enseignante Citoyenneté numérique Ressources pour les aides-élèves et éducatrices JEA - Prendre conscience de son influence : accès aux rediffusions (Immersion) Projets et initiatives Technologie éducationnelle
- FrancoSud
- CSCN
- CSCE
- CSNO
- Partenaires
SMB - Sciences 9e - Mme Lynn Fisher
- SIMDUT
- La classification de la matière
- Les changements chimiques vs les changements physiques
- Les éléments et le tableau périodique
- La loi de la conservation de la masse et la loi des proportions définies
- L'évolution du modèle atomique
- Les composés chimiques
- Les réactions chimiques
- L'indice de réaction
La classification de la matière
Le modèle particulaire de la matière :
1) Toute matière est formée d'infimes particules.
2) Toute substance pure est faite d'un type particulier de particules, différentes de particules d'un autre type de substance pure.
3) Il y a des forces d'attraction entre les particules.
4) Les particules sont toujours en mouvement.
5) La vitesse moyenne des particules est d'autant plus grande que la température est élevée.
Le modèle particulaire de la matière est un exemple de modèle scientifique. Les modèles scientifiques servent à représenter des processus impossible de voir à l'oeil nu.
On classe la matière selon son état : en gaz, en liquide ou en solide.
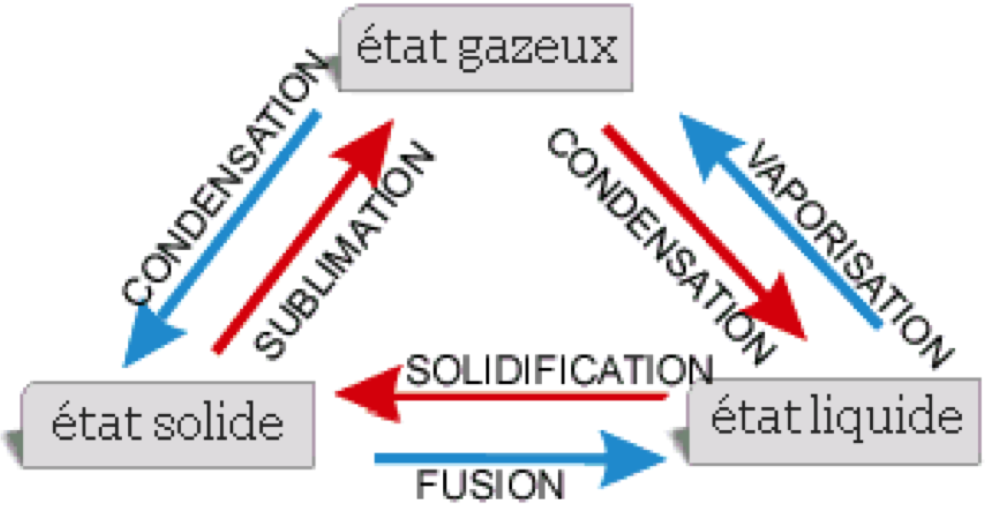
Les forces d'attraction que les particules exercent les unes sur les autres sont fortes dans les solides, moins fortes dans les liquides et faibles dans les gaz.

solide liquide gaz
On classe aussi la matière en fonction de sa composition : en mélanges et en susbstances pures.
Une substance pure est formée d'un seul type de particules.
P.ex. Les diamants sont formés d'atomes de carbone seulement.

Un mélange contient au moins 2 types de particules différentes.
P.ex. L'eau est formé d'atomes d'oxygène et d'hydrogène.

On classe les mélanges selon leurs propriétés :
Si les particules sont réparties uniformément, le mélange est dit homogène.
P.ex. Un mélange à gateau de vanille. Une fois bien mélangé, les ingrédients individuels ne peuvent pas être identifiés.

Si les particules ne sont pas distribuées uniformément, le mélange est dit hétérogène.
P.ex. Un mélange de farine et d'eau. Après avoir été bien brassé, le mélange parait uniforme. Cependant, après quelques secondes au repos, les particules de farine commencent à couler au fond et les deux composantes du mélange sont évidentes.

Les mélanges
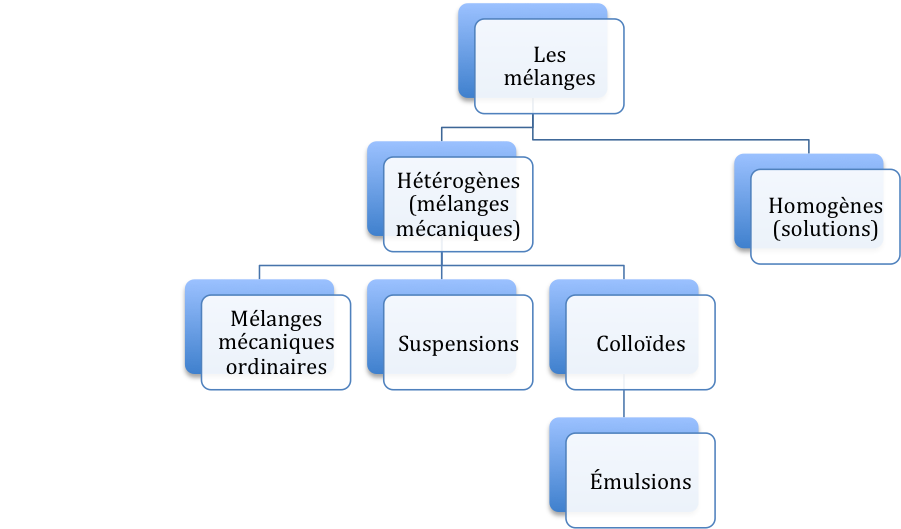
Les mélanges mécaniques ordinaires : Les constituants sont assez gros pour être visibles à l'oeil nu.
P.ex. Le granit. On peut voir les particules de quartz, de feldspath et de mica dont il est formé.

P.ex. Une pâte à biscuits aux pépites de chocolat. Les morceaux de chocolat sont visibles dans la pâte à biscuits.

Les suspensions : Des mélanges hétérogènes constitués de grosses particules réparties uniformément, mais qui se déposent si elles ne sont pas agitées.
- On peut séparer par filtration les constituants des mélanges de ce type.
P.ex. Des mélanges d'eau et de farine, de charbon de bois ou de craie broyée.

Les colloïdes : Sont des mélanges hétérogènes formés de petites particules réparties uniformément dans une seconde substance. Les particules sont tellement fines qu'elles restent en suspension.
- Les constituants des mélanges colloïdes ne peuvent pas être séparés par filtration.
P.ex. Le gel coiffant (des bulles en suspension dans le produit) et les nuages (des particules d'eau en suspension dans l'atmosphère).


Les émulsions : Ce sont des colloïdes formés de liquides dispersés dans des liquides.
P.ex. La mayonnaise, le lait et la vinaigrette.



Grâce à l'ajout d'un agent émulsifiant, un liquide peut rester dispersé dans un second liquide. Les agents émulsifiants sont ajoutés aux mélanges afin d'empêcher les particules de se séparer.
Toute matière possède des propriétés qui servent à l'identifier - des descripteurs qui nous aident à identifier certaines substances.
Ces propriétés sont des comportements caractéristiques de chaque substance.
P.ex. la solidité de la glace d'une patinoire, la douceur de la surface d'une feuille de papier, le goût de l'eau chlorée.
Les chimistes classent les changements de la matière en 2 catégories :
1) Les changements physiques
2) Les changements chimiques
Les changements physiques
- La forme d'une substance est modifiée, mais pas la composition chimique.
- Aucune nouvelle substance n'est produite.
- Les nouvelles propriétés sont temporaires, car le changement d'état est réversible.
P.ex. la fonte de glace

Les changements chimiques
- S'accompagne de la production d'une ou de plusieurs nouvelles substances;
- Il peut être difficile, ou même impossible, d'inverser un tel changement.
P.ex. Le papier qui brûle. Il est impossible de recombiner la fumée qui s'échappe avec le résidu noir solide de manière à reproduire la feuille de papier.

Il est parfois difficile de déterminer si un changement est de nature physique ou chimique.
Si tu observes un ou plusieurs des faits suivants, il s'est probablement produit un changement chimique :
- De la chaleur est libérée ou absorbée.
- La substance initiale est consommée (combustion).
- Il se produit un changement de couleur inattendu.
- Il se forme un précipité (solide) avec de nouvelles propriétés.
- Des bulles de gaz se forment dans un liquide (effervescence).
- Il est difficile ou impossible d'inverser le changement.
Les propriétés de la matière
Toute propriété observable ou mesurable sans avoir la formation d'une nouvelle substance est une propriété physique.
Toute propriété qui décrit la façon dont une substance réagit en présence d'une autre lorsqu'il y a formation d'une nouvelle substance est une propriété chimique.
| Propriétés chimiques |
| Réagit avec l'eau |
| Réagit avec l'air |
| Réagit avec l'oxygène pur |
| Réagit avec les acides |
| Réagit avec d'autres substances pures |
| Toxicité |
|
Stabilité |
On subdivise souvent les propriétés physiques en propriétés qualitatives et quantitatives.
Propriété qualitative : une caractéristique d'une substance que l'on peut décrire, mais que l'on ne peut pas nécessairement mesurer.
Propriété quantitative : une caractéristique mesurable d'une substance (p.ex. une température, une masse,...)
|
Propriétés physiques |
|
|
Qualitative |
Quantitative |
|
Couleur |
Point de fusion |
|
Texture |
Point d’ébullition |
|
Goût |
Masse volumique |
|
Odeur |
Solubilité |
|
État |
Conductivité électrique |
|
Forme de cristal |
Conductivité thermique |
|
Malléabilité Viscosité |
|
Qu'est-ce qu'un élément ?
Les philosophes de la Grèce antique croyaient que toute matière se compose de feu, d'eau, d'air et de terre. Ils ont appelé ces quatre composantes éléments.

Selon eux, toute matière dans le monde physique était une combinaison de ces quatre éléments et était dotée, à différents degrés, de propriétés comme la chaleur, la sécheresse, le froid ou l'humidité.
Il y a quelques centaines d'années, que les alchimistes et les pharmaciens ont commencé à développer les idées actuelles des éléments. Ils ont appris à décomposer la matière jusqu'à ce qu'ils ne puissent plus obtenir de nouveaux éléments. Ils réussissaient ainsi à déterminer si une substance est pure ou si c'est un mélange.
Antoine Lavoisier (1743 - 1794) a été un pionnier dans ce domaine. Il a défini les éléments comme des substances pures qu'aucun changement chimique ne peut décomposer (ou diviser) en substances plus simples. Il a réussit à classer 23 substances pures.

L'une des techniques les plus efficaces de Lavoisier a été la mesure minutieuse de la masse. Il mesurait la masse de toutes les substances prenant part à un changement chimique. Ses observations ont mené à l'élaboration de la loi de la conservation de la masse (on étudiera cette loi au prochain cours).
Au XIXe siècle, on a appliqué une nouvelle méthode à l'étude de la matière.
L'électrolyse
La pile voltaïque constituait une source fiable de courant électrique. Les scientifiques ont plus tard tenter de faire circuler un courant dans l'eau. Ils se sont rendus compte qu'il se formait des bulles d'hydrogène et d'oxygène, et que le niveau de l'eau baissait légèrement.
Ils ont déduit que l'eau s'était décomposée en hydrogène et en oxygène.
Le processus de décomposition d'un composé chimique par le passage d'un courant électrique est appelé électrolyse.
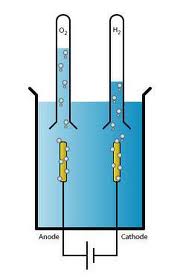
Grâce à l'électrolyse, les scientifiques ont réussi à isoler d'autres éléments, tels que le potassium, le sodium, le magnésium, le calcium, le strontium et le baryum.
Le chimiste qui découvrait un élément avait le privilège de la nommer.
P.ex. Marie Curie (première scientifique à recevoir 2 prix Nobel) qui a découvert le polonium, a nommé cet élément d'après son pays natal, la Pologne.
P.ex. L'élément "einsteinium" a été nommé en souvenir d'Albert Einstein.
Comme il serait difficile d'écrire chaque fois au long le nom des éléments, on a élaboré un système de symboles chimiques.
P.ex. le symbole du lithium est Li; celui du bore est B; celui du magnésium, Mg.
Même si les éléments n'ont pas le même nom dans toutes les langues et qu'un même nom peut s'écrire différemment dans plusieurs langues, le symbole de n'importe quel élément est identique dans toutes les langues.
C'est ce qu'on appelle la nomenclature IUPAC (International Union of Pure and Applied Chemistry).
On classe les éléments en métaux, non-métaux et métalloïdes :
Les métaux
- conduisent bien l'électricité et la chaleur;
- malléables (on peut les façonner au marteau) et ductiles (on peut les étirer);
- ils ont un aspect brillant;
- ils sont tous solides à la température ambiante, sauf le mercure.
P.ex. l'argent

*Les métaux sont représentés en rose dans le tableau périodique.

Les non-métaux
- à la température ambiante, certains sont gazeux, tandis que les autres sont solides, à l'exception du brome, qui est liquide;
- il sont plutôt ternes;
- les non-métaux solides sont cassants et non ductiles;
- ce sont des mauvais conducteurs d'électricité et de chaleur.
P.ex. le soufre

*Les non-métaux sont représentés en bleu dans le tableau périodique.
Certains éléments, dont le silicium, présentent des propriétés intermédiaires entre celles des métaux et des non-métaux. On les appeles "métalloïdes". Il existe peu de métalloïdes.
Les métalloïdes
- ils sont solides;
- peuvent être brillants ou ternes;
- peuvent conduire de l'électricité mais sont de mauvais conducteurs de chaleur;
- il sont cassants et non ductiles.
*Les métalloïdes sont représentés en jaune dans le tableau périodique.
Les familles chimiques
Une famille chimique est un groupe d'élément apparentés, qui possèdent des propriétés semblables. Les familles (ou groupes) dutableau périodique forment les colonnes. Cela veut donc dire que les colonnes du tableau périodique contient des éléments qui partagent en gros des propriétés physiques et chimiques. Le tableau périodique comprend 18 groupes. Ceux-ci sont mis en évidence dans le tableau ci-dessous :
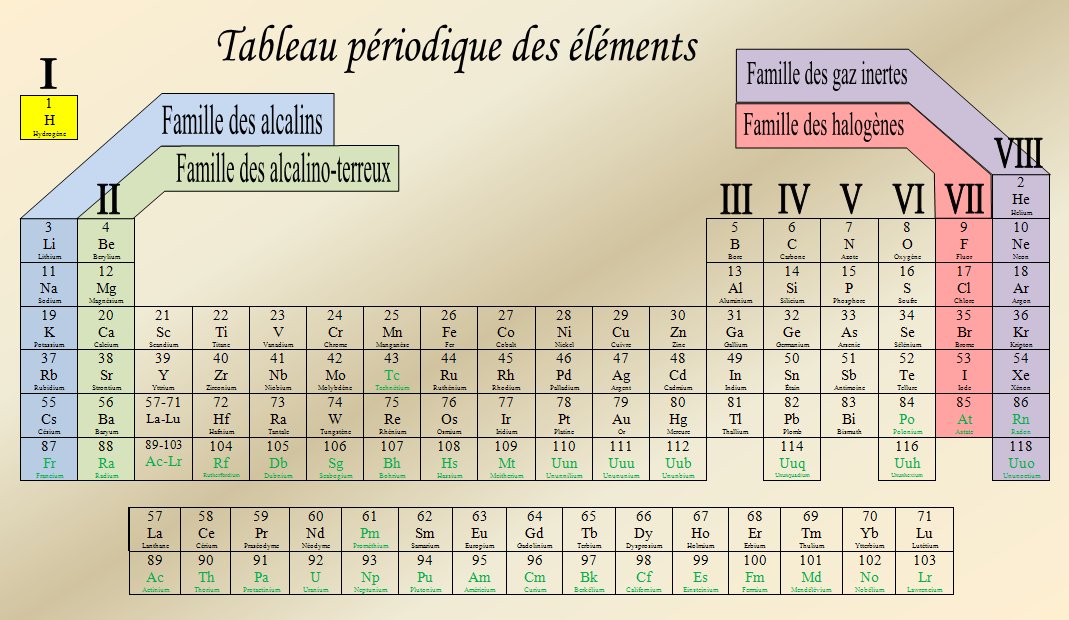
Chaque rangé (ou ligne) du tableau périodique est appelée une période. Il y a 7 périodes dans le tableau périodique. Le schéma suivant illustre les périodes.

Les métaux alcalins
- la plupart sont réactifs;
Les métaux alcalino-terreux
- réagissent plutôt vigoureusement avec certaines substances, mais ils sont moins réactifs que les métaux alcalins.
Les halogènes
- réagissent vigoureusement avec presque n'importe quel autre élément;
- même les halogènes les moins réactifs sont très corrosifs et toxiques.
Utilité : On ajoute des composés de fluor à des dentifrices et à l'eau des réseaux d'approvisionnement de certaines villes. Ces substances aident à prévenir les caries en renforçant l'émail des dents et en les rendant plus résistantes à la carie.
Les gaz nobles (ou gaz inertes)
- réactivité faible;
- ils sont tous chimiquement stable.
Utilité : Avec l'usage, le filament de tungstène à l'intérieur des ampoules éventuellement brûlera. Afin d'éviter des incendies causés par les ampoules, On remplit les ampoules d'un gaz noble comme l'argon au lieu de l'oxygène. L'argon étouffe les étincelles avant qu'elles puissent causer des dommages.
Au milieu du XIXe siècle, les chimistes avaient déjà découvert 58 éléments, mais personne ne savait combien il pourrait en exister en tout.
Durant les années 1860, plusieurs scientifiques ont essayé de classer les éléments connus en fonction de la masse atomique.
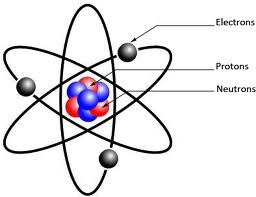
La masse atomique d'un élément est la masse moyenne d'un atome de cet élément. La masse atomique d'un atome d'un élément en particulier a une a une masse atomique différente de celle des atomes d'un autre élément.
Dmitri Ivanovitch Mendeleïv (1834 - 1907) a finalement créé un système tellement précis, qu'il est encore en usage aujourd'hui.
Il a rédigé une fiche pour chacun des éléments connus. Ses fiches ressemblaient à la fiche suivante :
p.ex. silicium
masse atomique : 28,1
masse volumique : 2,3 g/cm3
couleur : gris foncé
point de fusion : 1410oC
point d'ébullition : 3265oC
formule de l'oxyde : SiO2
Mendeleïv a fixé toutes ses fiches au mur, en ordre croissant des masse atomiques, et il pris des mois pour vérifier différents arrangements formés de lignes et de colonnes.
En disposant les éléments par ordre croissant des masses atomiques, Mendeleïv s'est rendu compte que les propriétés des éléments se répétiaent à intervalles fixes ou périodiques.
Le modèle qu'il a découvert a été appelé le tableau périodique.
Vers 1915, les chimistes et les physiciennes et physiciens avaient élaboré des modèles de la structure atomique, et il était devenu évident que la périodicité des propriétés chimiques dépend de la structure atomique. On a donc réorganisé le tableau périodique sur la base de la structure atomique plutôt que de la masse atomique.
Le tableau périodique moderne qui en est résulté est fondé sur un nombre précis pour chaque élément : le numéro atomique.
Le numéro atomique d'un élément est égal au nombre de protons du noyau d'un atome de cet élément.
P.ex. élément : fluor
symbole : F
numéro atomique : 9
masse atomique : 18,998
Le numéro atomique du fluor est 9, ce qui signifie que le noyau d'un atome de fluor contient 9 protons.
Puisque tous les atomes sont neutres, leurs charges positives et négatives doivent s'annuler. Autrement dit, un atome renferme un même nombre d'électrons et de protons.
p.ex. élément : calcium
numéro atomique : 20
masse atomique : 40,078
nombre de protons : 20
nombre d'électrons : 20
Les chimistes utilisent un autre nombre, appelé nombre de masse pour indiquer le nombre total de protons et de neutrons d'un atome.
nombre de protons + nombre de neutrons = nombre de masse
Si tu connais le numéro atomique et le nombre de masse d'un élément, tu peux calculer le nombre de neutrons en effectuant une simple soustraction :
nombre de masse - numéro atomique = nombre de neutrons
Exercices - Le numéro atomique et le nombre de masse
Corrigé - Le numéro atomique et le nombre de masse
La loi de la conservation de la masse
Au cours d'un changement chimique, la masse totale des substances finales est toujours égale à la masse total des substances initiales.
---------------------------------------------------------------------------------------------------------------

L'importance accordée par Lavoisier à la mesure de la masse a incité d'autres scientifiques à séparer des composés en éléments, puis à mesurer la masse de chaque élément.
Les résultats de leurs expériences les ont amenés à formuler la loi des proportions définies.
-------------------------------------------------------------------------------------------------------
La loi des proportions définies
Un composé est une substance pure formée de deux ou plusieurs éléments selon des proportions fixes (ou définies).
-------------------------------------------------------------------------------------------------------
P.ex. l'eau
L'eau pure est toujours constituée de deux éléments, soit l'hydrogène et l'oxygène, combinés dans les proportions suivantes :
2 atomes d'hydrogène pour une atome d'oxygène
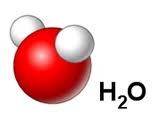
Ces proportions sont toujours les mêmes quelle que soit la source de l'eau.
P.ex. le peroxyde d'hydrogène
Il est formé des deux mêmes éléments, mais dans des proportions différentes :
2 atomes d'hydrogène pour chaque 2 atomes d'oxygène
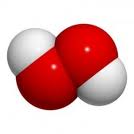
Ces proportions ne varient jamais d'un échantillon de peroxyde d'hydrogène à l'autre.
La composition des substances pures est constante, de sorte qu’elles ont tendance à présenter des propriétés constantes et invariables.
On peut ainsi déterminer une substance inconnue en mesurant l’une de ses propriétés, puis en comparant cette quantité à des valeurs connues.
Le modèle particulaire de la matière ne fournit pas d’explication sur la combinaison et la décomposition de particules de substances distinctes.
John Dalton (1766-1844) a mis au point une théorie atomique qui constituait une nouvelle approche pour expliquer les faits et les lois chimiques.
La théorie atomique de Dalton
- Toute la matière est formée de petites particules appelées atomes.
- Il est impossible de créer ou de détruire des atomes, ou de les diviser en particules plus petites.
- Tous les atomes d’un élément donné ont la même masse et la même taille. La masse et la taille des atomes d’un élément donné diffèrent de la masse et de la taille des atomes d’autres éléments.
- Les composés résultent de l’union, dans des proportions définies, d’atomes d’éléments distincts.
Le modèle de Dalton repose sur l’idée que les éléments sont différents parce que leurs « particules » (ou atomes) sont différentes.
Il permet de définir de façon précise les notions d’élément et de composé.
élément : une substance pure formée d’un seul type de particules, ou atomes.
Chaque élément possède des propriétés qui lui sont propres, et aucun changement chimique ne permet de le diviser en substances plus simples.
composé : une substance pure résultant de la combinaison chimique de deux ou plusieurs éléments.
Il est possible de diviser un composé en ses éléments constitutifs au moyen d’un changement chimique.
Les lois, les théories, les modèles et les observations
Une loi scientifique décrit et résume ce qui se passe.
Une théorie est une façon créative d’expliquer pourquoi telle ou telle chose se produit.
Au cours d’une expérience scientifique, les chercheurs et chercheures observent le comportement et les réactions de la matière. Il faut souvent faire des milliers d’observations et des centaines d’expériences avant qu’une théorie ne soit acceptée par les scientifiques.
Les idées scientifiques sont souvent modifiées au fur et à mesure que l’on rassemble de nouveaux faits. La plus grande partie de la théorie de Dalton a résisté à l’épreuve du temps. Cependant, des scientifiques ont découvert qu’il existe des particules plus petites que les atomes.
L'évolution du modèle atomique...
la particule de Dalton (1810);

le modèle de "muffin aux raisins" de Thomson (1897);

le modèle planétaire de Rutherford (1911);

le modèle atomique de Bohr (1913);
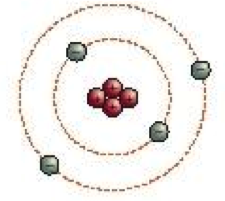
le modèle du nuage d'électrons (aujourd'hui).
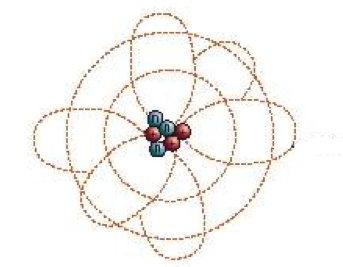
Les modèles scientifiques servent à représenter les structures et les processus qui ne sont pas observables directement.
Un bon modèle fournit une explication satisfaisante de ce qu’on observe indirectement et de ce que les scientifiques déduisent de leurs observations.
Il y a 118 éléments existant et ils peuvent se combiner par groupes de deux, de trois ou plus pour former des composés.
Les atomes sont retenus ensembles par des liens chimiques. Ces liens se forment lorsque des éléments gagnent, perdent ou partagent des électrons.
Une formule chimique utilise des symboles et des chiffres pour représenter la composition d’une substance pure.
p.ex.
l'eau, H2O : contient deux atomes d'hydrogène et un atome d'oxygène
le propane, C3H8 : contient trois atomes de carbone et huit atomes d'hydrogène
Chaque symbole dans une formule chimique correspond à un atome d’un élément. S’il y a plus d’un atome de cet élément, un petit nombre est écrit en indice suit directement le symbole de l’élément. L’inscription en indice désigne le nombre d’atomes.
Une molécule se compose généralement d’un ensemble d’atomes liés les uns aux autres.
Les molécules diatomiques sont celles qui comportent deux atomes du même élément.
p.ex. l'hydrogène, H2
l'oxygène, O2
l'azote, N2
Un composé formé de deux éléments est appelé un composé binaire.
Les composés moléculaires
Lorsque un atome d'un élément non-métal partage ses électrons avec un autre atome non-métallique, on obtient un composé moléculaire.
La majorité des composés moléculaires ne forment pas de grandes structures.
Les liaisons entre les atomes (liaisons intramoléculaires) sont fortes, mais l’attraction entre les molécules (liaisons intermoléculaires) est relativement faible.
Lorsque tu fais fondre ou fais évaporer un composé moléculaire, tu dois fournir assez d’énergie pour vaincre l’attraction entre les molécules . Puisque cette attraction est faible, beaucoup de composés moléculaires ont des points de fonte et d’ébullition assez bas.
Comment nomme-t-on les composés moléculaires ?
L’Union internationale de chimie pure et appliquée (UICPA) est une organisation de scientifiques chargés d’établir des normes dans le domaine de la chimie.
Les comités font des recommandations concernant la façon dont on devrait nommer les éléments.
Les composés binaires moléculaires suivent les règles suivantes :
1. Identifie les éléments présents dans la molécule.
p.ex. H2O
2. Écris le nom des deux éléments, dans l'ordre présenté dans la formule chimique du composé.
p.ex. hydrogène oxygène
3. Remplace la terminaison du nom du deuxième élément par –yde (dans le cas de l’oxygène), ou par -ure (dans tous les autres cas).
p.ex. le deuxième élément est l'oxygène. On doit changer sa terminaison par -yde.
Oxygène devient donc oxyde.
4. Utilise un préfixe indiquant le nombre de chaque type d’atome dans les formules:
mono- pour 1, bi- ou di- pour 2, tri- pour 3, et tétra- pour 4
p.ex. dihydrogène monoxyde
5. Change l'ordre des éléments, relis les deux éléments par "de" et écris l’état du composé entre parenthèses.
monoxyde de dihydrogène liquide
Comme vous voyez, le monoxyde de dihydrogène est le nom chimique de l'eau!
Pratique-toi maintenant avec le CH4 (g)!
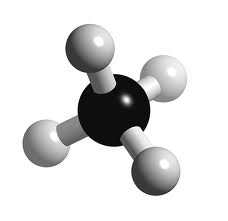
Réponse : tétrahydrure de monocarbone gazeux (méthane)
Si tu veux convertir la forme écrite en formule chimique :
p.ex. tétrafluorure de carbone gazeux (nom chimique)
fréon (nom commun)
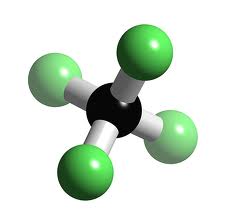
1. Écris les symboles correspondants aux éléments dans l’ordre inverse de leur apparition
dans la forme écrite.
C F
2. Indique le nombre de chaque type d’atome par un chiffre en indice.
C F4
3. Indique son état entre parenthèses (s = solide, l = liquide et g = gaz).
CF4 (g)
Pratique-toi maintenant avec le tribromure de bore gazeux!
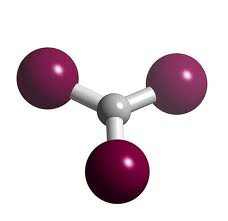
Réponse : BBr3 (g)
Les composés ioniques
Lorsqu’un atome gagne ou perd des électrons, il perd sa neutralité.
Il est devenu un ion, une particule ou un groupe de particules ayant une charge positive ou négative.
En temps normal, les atomes sont neutres car ils contiennent un nombre égal de charges négatives (électrons) et de charges positives (protons).
p.ex. Un atome de sodium contient 11 protons et 11 électrons. Si un atome de sodium perd un électron à un atome de chlore, le sodium a maintenant 11 protons, mais seulement 10 électrons, ce qui rend l’ion positif.
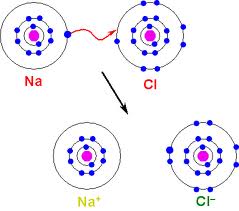
Le réarrangement de forces électroniques laisse à l’atome de chlore une faible charge négative et à l’atome de sodium, une faible charge positive.
À la place de ces deux éléments, les atomes (devenus ions) forment maintenant un composé ionique: chlorure de sodium (NaCl ou sel).

Les forces qui maintiennent chaque ion en place sont des liaisons ioniques.
L’atome qui perd ou qui gagne des électrons perd ainsi ses propriétés originales.
Voici quelques propriétés des composés ioniques et moléculaires.
|
composé ionique |
composé moléculaire |
|
- Formé d’éléments métalliques et non- métalliques |
- Habituellement formé uniquement d’éléments non- métalliques |
|
- Forme des ions en solution (soluble) |
- Ne forme pas d’ion en solution (non soluble) |
|
- Conduit l’électricité |
- Ne conduit habituellement pas l’électricité |
|
- Solide à température ambiante (dur) |
- Solide, liquide ou gazeux à température ambiante |
La conductibilité est la propriété qu’a une substance de conduire un courant électrique.
Les composés ioniques se séparent en ions + (cation) ou – (anion) lorsqu’ils se dissolvent dans l’eau…pourquoi?
Des particules chargées peuvent aussi conduire un courant électrique à travers l’eau.
Comment nomme-t-on les composés ioniques ?
1. Identifies les éléments présents dans la formule chimique.
p.ex. SrCl2
2. Le nom de l’élément non-métallique est placé en premier, avec sa terminaison changée en -yde (pour l'oxygène) ou en –ure (pour tout autre élément).
p.ex. strontium (métal) chlore (non-métal)
chlorure strontium
3. Les nombres en indice indiquent le rapport ionique du composé.
p.ex. Dans la formule SrCl2, le rapport entre le strontium et le chlore est 1:2.
Attention!!! On ne se sert pas des préfixes dans la nomenclature des composés ioniques!!!!
Pratique-toi avec les exemples suivants :
NaF
LiCl
ZnS
Réponses :
NaF = fluorure de sodium
LiCl = chlorure de lithium
ZnS = sulfure de zinc
corrigé - questions de révision
Fiche de nomenclature - les composés moléculaires
corrigé - fiche de nomenclature - les composés moléculaires
Les propriétés des produits diffèrent de celles des réactifs. Les changements de couleur, de température et d'odeur ne témoingnent pas toujours d'une réaction chimique.
On peut décrire une réaction chimique en écrivant une équation en mots qui identifie les réactifs et les produits.
p.ex. argent + brome → bromure d’argent
Ag(s) + Br(l) → AgBr(s)
Puisqu’une molécule de brome est une molécule diatomique,
Ag(s) + Br2(l) → AgBr(s)
Remarque que cette équation n’est pas équilibrée. C’est-à-dire qu’il n’y a pas le même nombre d’atomes de chaque élément les deux côté de l’équation. Afin qu'elle soit équilibrée, il faut 2 molécules d'argent pour réagir avec 1 molécule diatomique de brome pour donner 2 molécules de bromure d'argent.
2 Ag(s) + Br2(l) → 2 AgBr(s)
p.ex. Le magnésium, un solide, s’utilise pour créer une lumière éclatante dans les feux d’artifice et les lampes de caméra. L’oxyde de magnésium formé, d’une couleur gris clair, s’effrite facilement.

La forme écrite pour cette réaction est:
magnésium + oxygène → oxyde de magnésium
L’équation chimique équilibrée pour la réaction du magnésium au contact de l’oxygène est:
2 Mg(s) + O2(g) → 2 MgO(s) + lumière
Puisque la loi de la conservation de la masse dit qu’aucun atome ne se perd ou ne se crée dans une réaction chimique, les atomes pour former des nouvelles substances.
p.ex. Lorsque tu mélanges du vinaigre et du bicarbonate de sodium, une réaction chimique énergique se produit.
HC2H3O2(aq) + NaHCO3(s) → NaC2H3O2(aq) + H2O(l) + CO2(g)
vinaigre + bicarbonate de soude = acétate de sodium + eau +
dioxyde de carbone (bulles d'air)
Les liaisons chimiques renferment de l’énergie. Pour briser les liaisons, il faut ajouter de l’énergie. Lorsque les liaisons se forment, l’énergie est relâchée.
Les réactions exothermiques
L’énergie est soit produite ou absorbée lors d’une réaction chimique.
Les réactions chimiques qui produisent de la chaleur sont appelées
Une réaction exothermique est une réaction qui produit ou libère de la chaleur.
p.ex. Lorsque le méthane contenu dans le gaz naturel est brûlé dans un appareil de chauffage, il se crée de l’énergie sous forme de chaleur:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) + chaleur
Les réactions endothermiques
L’énergie est parfois absorbée lors d’une réaction chimique.
Une réaction endothermique est une réaction absorbant l’énergie, donnant l'impression que le produit est froid.
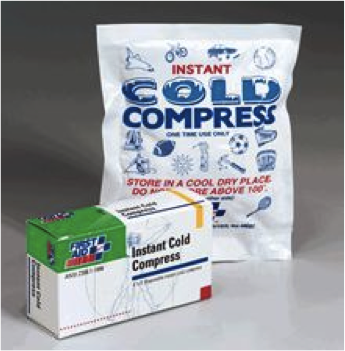
Chaud ou froid
Les compresses tant chaudes que froides peuvent servir à soulager les blessures des athlètes.
On produit parfois le changement de température par la dissolution d’un solvant dans l’eau.
Les compresses chaudes (réaction exothermique) ont généralement recours au chlorure de calcium (CaCl2), alors que des compresses froides (réaction endothermique) utilisent généralement le nitrate d’ammonium (NH4NO3).

Les réactions chimiques peuvent se passer à différentes vitesses. Pourquoi une réaction est-elle plus lente qu'une autre ? Comment peut-on ralentir ou accélérer une réaction chimique ?
L’indice de réaction est une mesure de la vitesse à laquelle se produit une réaction.
Pour le définir, tu peux mesurer soit la vitesse de disparition d’un des réactifs, soit la vitesse à laquelle un des produits apparaît.
Les deux mesures montrent comment la substance change par unité de temps.
La température
On peut ralentir ou accélérer l’indice des réactions chimique en changeant la température.
- À une température plus élevée, l’indice de réaction augmente.
- Les molécules et les atomes se déplacent plus vite, entre plus fréquemment en collision et, peuvent donc former de nouvelles substances plus rapidement.
p.ex. La température élevée à l’intérieur d’un four accélère les réactions chimiques qui transforment une pâte liquide en un gâteau.

On conserve les fruits et les légumes frais le plus souvent dans un réfrigérateur, afin de ralentir les réactions chimiques.

Remuer
On peut accélérer l’indice des réactions chimique en remuant.
- Les molécules et les atomes se déplacent plus vite, entrent plus fréquemment en collision.

Taille des particules
On peut accélérer l’indice des réactions chimique en modifiant la taille.
- Si la taille des particules est plus petite, la réaction chimique pourra se produire sur une plus grande surface et la réaction pourra se faire plus rapidement.
La concentration
On peut accélérer l’indice des réactions chimique en augmentant la concentration des réactifs.
- Si tu augmentes la concentration de la substance, tu augmenteras le nombre de particules de cette dernière par unité de volume et donc la vitesse de réaction.
Les catalyseurs
On peut aussi influer sur l’indice de réaction en ajoutant une substance appelée catalyseur.
Un catalyseur est une substance qui accélère l’indice de réaction sans être lui-même modifié.
Attention!!! Un catalyseur n’influe pas sur la quantité de produits engendrés par la réaction chimique. Il augmente seulement la vitesse de la réaction.
Une enzyme est un catalyseur naturel produit par les êtres vivants. Presque toutes les réactions chimiques qui surviennent dans le corps sont catalysées par des enzymes.
p.ex. Lorsque tu mâches un morceau de pain, les glandes dans ta bouche produisent de la salive, qui contient des enzymes.

Les enzymes contenues dans la salive agissent comme des catalyseurs qui aident à réduire les morceaux de nourriture en plus petits morceaux, et ensuite en molécules.
p.ex. Lorsqu’un corps étranger pénètre dans ton œil, une enzyme dans les larmes attaque les parois cellulaires des bactéries, empêchant ainsi qu’elles affectent l’œil.

p.ex. Quelques détergents à lessive contiennent des enzymes qui décomposent les protéines à l’origine de beaucoup de taches sur les vêtements.

Tu observeras les effets d’un catalyseur lors de la prochaine expérience. :)
Les inhibiteurs
Au contraire des catalyseurs, nous avons les inhibiteurs. Les inhibiteurs sont des substances qui ralentissent les réactions chimiques.
p.ex. Certaines plantes possèdent des inhibiteurs naturels dans leurs graines pour empêcher la germination jusqu’à ce que les conditions soient propices.

p.ex. On ajoute des inhibiteurs à beaucoup d’aliments et de médicaments pour ralentir leur décomposition. On ajoute aussi un inhibiteur au peroxyde d’hydrogène en bouteille pour éviter que ses molécules ne se décomposent trop rapidement.
La corrosion
Lorsque les métaux sont exposés à l’air et à l’humidité, ils subissent une réaction chimique et se corrodent progressivement.
La corrosion est l’oxydation des métaux ou des pierres en présence d’air (surtout l'oxygène) et d’humidité (l'eau).

p.ex. La rouille est de l’oxyde de fer, un produit de la réaction chimique entre le fer, l’oxygène et l’humidité.
4 Fe(s) + 3 O2(g) → 2 Fe2O3(s)

Les matériaux corrodés perdent leur consistance. Une fois que la couche supérieure du métal s’est corrodée, une plus grande partie de la surface est exposée. L’oxygène provenant de l’air peut alors atteindre les couches plus profondes.
Empêcher la corrosion
On peut protéger le métal de la corrosion en appliquant une fine couche de peinture.
Une autre manière de le protéger est de le revêtir de zinc, lequel offre plus de résistance à la corrosion. Le revêtement de métaux par une fine couche de zinc est appelé galvanisation.

Les maisons et édifices en construction sont exposés à l’humidité et à l’air, ce qui peut faire corroder des éléments métalliques avant que la construction ne soit achevée.
Si les clous et autres éléments métalliques sont galvanisés, la corrosion n’est plus alors un problème sérieux.
On peut également employer d’autres métaux comme couche protectrice contre la rouille.
p.ex. Certains pare-chocs sont revêtus d’une fine couche de chrome (Cr) pour protéger le fer de la corrosion.
La combustion
La combustion est la combinaison hautement exothermique d’une substance avec l’oxygène.

La combustion requiert de la chaleur, de l’oxygène et du carburant.
p.ex. La combustion se produit dans un foyer, dans un BBQ au gaz ou dans la fournaise de ta maison.
p.ex. La réaction de la combustion de l’acétylène en présence de l’oxygène est donnée par:
2 C2H2(g) + 5 O2(g) → 4 CO2(g) + 2 H2O(g) + énergie
acétylène + oxygène → dioxyde de carbone + eau + chaleur

p.ex. La combustion du propane dans un barbecue.
L’équation pour la combustion du propane est donnée ci-dessous:
C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(g) + énergie
propane + oxygène → dioxyde de carbone + eau + chaleur
Compare l’équation pour la combustion de l'acétylène avec celle de la combustion du propane. Qu’ont-elles en commun?
Les produits!!!
- le dioxyde de carbone;
- l’eau;
- la libération de l’énergie (chaleur).
